Kalneksin
Kalneksin je lektinski šaperon veličine 67kDa, integriran u membrani endoplazmatskog retikuluma. Jedna od njegovih najvažnijih funkcija je da pripomaže u savijajnju pogrešno savijenih proteina zajedno s foldazama endoplazmatskog retikuluma. Njegov manjak u organizmu može dovesti do određenih defekata.
Otkriće
Retikularna mreža membrana u citoplazmi koja okupira veliki dio stanice (doseže čak i do jezgrine membrane) otkrivena je pomoću imunofluorescencije stanične kulture koristeći antitijela i naziva se endoplazmatski retikulum. Nedugo nakon toga, 1982. godine u mikrosomima psećeg pankreasa detektiran je novi fosfoprotein nazvan pp90 vezan na endoplazmatski retikulum. Ime potječe od tadašnjeg saznanja da je protein veličine 90 kDa.[1]
Molekularnim kloniranjem i karakterizacijom otkriveno je da se radi o membranskom proteinu tipa 1, slične strukture kalretikulinu. Dano mu je ime kalneksin. On, zajedno s kalretikulinom i ERp57 (također poznat kao PDIA3), tvori ključne komponente puta koji olakšava savijanje i kontrolu kvalitete novosintetiziranih proteina s N-povezanim bočnim lancima ugljikohidrata.[1]
Struktura
Gen za ljudski kalneksin (CANX) nalazi se prema distalnom kraju dugog kraka kromosoma 5 (5q35.3 lokus) koji se proteže oko 33 kbp i sastoji se od 15 egzona (https://hr.wikipedia.org/wiki/Egzon), stvara transkript od 4915 bp koji se prevodi u polipeptid od 592 aminokiseline.[1]
Ljudski polipeptid kalneksina protein je od 67 kDa, ali se često pogrešno smatra proteinom od 90 kDa zbog visokog sadržaja kiselinskih ostataka koji elektrostatski odbijaju SDS što rezultira nedovoljnom elektromotornom snagom i smanjenom elektroforetskom pokretljivošću na SDS-PAGE-u.[1]
Polipeptid kalneksina sastoji se od tri domene: N-terminalnog intraluminalnog dijela, transmembranskog segmenta i C-terminalne domene okrenute prema citosolu.[1]
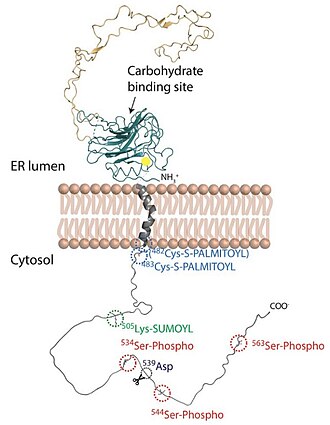
N-terminalna domena
Luminalna (N-terminalna) domena kalneksina odgovorna je za njegovu funkciju šaperona sličnu lektinu i mjesto je interakcije s ciklofilinom B, ERp29 i ERp57. Također, sadrži 20 aminokiselinskih ostataka N-terminalnog signalnog slijeda koji je odgovoran za ciljanje kalneksina. Sadrži 2 različite strukturne komponente: kompaktna globularna domena prema N-kraju (N-domena) i izdužena domena bogata prolinom poput kraka (P-domena) prema C-kraju. N-domena sastavljena je od konkavnih i konveksnih antiparalelnih ß ploča koji imaju sedam niti i zajedno tvore sendvič strukturu. P-domena proteže se 140 Å od N- domene i tvori veliku petlju ukosnicu. Ta se petlja sastoji od dvije vrste motiva (motiv 1 i motiv 2) ponavljanih sekvenci bogatih prolinom. Svaka kopija motiva 1 u interakciji je s kopijom motiva 2 u obliku glava i rep interakcije.[1]
3D struktura luminalne domene pokazuje samo jedno pretpostavljeno koordinirano mjesto vezanja Ca2+. To mjesto visoko je očuvano između kalneksina i kalretikulina, budući da P-domena kalretikulina također veže jedan Ca2+ ion visokog afiniteta. Štoviše, unos Ca2+ u luminalni dio igra strukturnu ulogu pokrećući Ca2+-ovisne konformacijske promjene. Osim toga, luminalna domena kalneksina veže Zn2+ i ATP; oba reguliraju konformacijske promjene, dok sam ATP poboljšava sposobnosti supresije agregacije in vitro, a Zn2+ olakšava vezanje ERp57.[1]
Transmembranska domena
Korištenjem simulacije molekularne dinamike saznalo se da je jedna transmembranska domena sastavljena od α heliksa. Pro494 približno na sredini alfa heliksa uvodi nagib od ~30 ° u odnosu na površinu membrane. Pretpostavljeno je da ova domena ima ulogu u sidrenju kalneksina na membranu, ali doprinosi i šaperon funkciji.[1]
C-terminalna domena
Vrlo malo se zna o C-terminalnoj domeni te do danas nema strukturnih informacija o njoj. Poznato je da C-terminalna domena igra važnu ulogu u zadržavanju kalneksina u endoplazmatskom retikulumu jer ova domena sadrži RKPRRE motiv, koji djeluje kao retencijska sekvenca. Za ovaj vrlo kiseli segment dug 90 aminokiselina smatra se da je fleksibilan i nestrukturiran. Anionski karakter C-terminalne domene kalneksina daje ovoj domeni višestruki niski afinitet, ali zato Ca2+-vezna mjesta visokog kapaciteta. C-terminalna domena izložena citosolu prolazi kroz post-translacijske modifikacije, koje uključuju palmitoilaciju, fosforilaciju, sumoilaciju i proteolitičko cijepanje.[1]
Lokalizacija
Kalretikulin i kalneksin dijele strukturnu sličnost s obzirom na njihove domene slične lektinu, pri čemu je kalretikulin protein koji boravi u lumenu, dok je kalneksin integralni membranski protein endoplazmatskog retikuluma. Danas je dobro utvrđeno da se kalneksin eksprimira u svim stanicama koje sadrže membranu ER-a i vrlo je dobro očuvan među vrstama (biljke, gljive, životinje) pokazujući važnost šaperon domene.[2]
Funkcija
Jedna od glavnih funkcija kalneksina je da koordinira procesiranje novosintetiziranih N-vezanih glikoproteina s njihovim ispravnim savijanjem.[2] U ciklusu kalneksina, proteini s monoglukoziliranim glikanima vežu se za lektinske šaperone kalneksin i kalretikulin.[3] Time se potiče savijanje proteina kojemu pripomažu foldaze protein disulfid izomeraza ERp57, peptidil prolil cis-trans izomeraza CypB i disulfid izomeraza ERp29. Nakon podrezivanja terminalne glukoze pomoću glukozidaze II, glikani se više ne mogu vezati za lektinske šaperone.[3]
Za one proteine koji se još nisu ispravno savili, enzim UDP-glukoza:glikoprotein glukoziltransferaza (UGGT) djeluje kao kontrolna točka te dodaje glukozu natrag u N-glikan. Ovo omogućuje da se pogrešno savijeni proteini mogu ponovno povezati sa šaperonima za opetovane krugove savijanja posredovanog šaperonima [3]. Ispravno savijeni proteini transportiraju se do Golgija.[3]
Kalneksin djeluje i kao regulator Ca2+ tijekom fototransdukcije i dodatno kao šaperon u sazrijevanju rodopsina (Rh1).[4] Mutacije u kalneksinu Drosophile dovele su do ozbiljnih nedostataka u ekspresiji Rh1 i sposobnosti fotoreceptorskih stanica da kontroliraju razine Ca2+ u citosolu nakon aktivacije tranzicijskog potencijalnog receptorskog kanala (TRP) osjetljivog na svjetlo.[4]
Kalneksin veže i ATP iako još nije otkrivena aktivnost ATPaze.[5]
Interakcija s drugim proteinama
Kalneksin stupa u interakciju sa širokim nizom novosintetiziranih membranskih ili topivih proteina koji prolaze kroz endoplazmatski retikulum. Prvenstveno je u kooperativnoj interakciji s foldazama ERp57, CypB i ERp29. Što se tiče interakcije između kalneksina i Erp57, P-domena kalneksina u interakciji je s osnovnim C-krajem ERp57, kao dio kalneksinskog ciklusa za usmjeravanje stvaranja disulfidnih veza u N-glikoproteinima.[6]
Također, dokazana je interakcija između dva kalneksina i ERp29 preko njihovih P domena.[7] Formiranje dimera ERp29 i interakcija kalneksin-ERp29 odgovorna je za umrežavanje više kalneksina, a dimerizacija kalneksina nije uzrokovana kemijskim crosslinker-om.[7] Posljednje, CypB je u interakciji s P-domenom kalneksina. Kompleks ciklofilina B s kalneksinom i drugim lektinskim šaperonima sugerira da ciklofilin B djeluje u ciklusu kalneksina na način analogan ERp57.[8]
Važna je uloga kalneksina u procesuiranju antigena. Kalneksin se povezuje s nezrelim αβI, ali ne i sa zrelim αβ kompleksima.[9]
Optimalne interakcije između receptora i kalneksina kritično reguliraju promet i ekspresiju D1 i D2 dopaminskih receptora na površini stanice, mehanizam koji je vjerojatno važan za mnoge receptore spregnute s G-proteinom.[10]
Faktor VIII (FVIII) i faktor V (FV) homologni su kofaktori koagulacije koji dijele sličnu organizaciju domene (A1-A2-B-A3-C1-C2) i oba su glikozilirana unutar svojih B-domena. FVIII i FV pokazali su interakciju s kalretikulinom tijekom prolaska kroz sekretorni put.[11] FVIII s izbrisanom B-domenom značajno je smanjio interakciju kalneksina i kalretikulina, što ukazuje da B-domena može predstavljati primarno mjesto interakcije ova dva šaperona.[11]
Pacijenti zaraženi HIV-om izloženi su povećanom riziku od razvoja ateroskleroze, dijelom zbog niže modulacije i funkcionalnog oštećenja transportera kolesterola ATP-vezujuće kazete A1 (ABCA1) od strane HIV-1 proteina Nef.[11] Mehanizam ovog učinka uključuje interakciju Nef-a s kalneksinom i prekidanje vezanja kalneksina na ABCA1, što dovodi do zadržavanja ABCA1 u ER-u, njegove razgradnje i rezultirajuće supresije efluksa kolesterola.[12]
Bolesti
Kalneksin može biti modulator genetičkih bolesti.[13]
Nadalje, manjak kalneksina može voditi mijelinopatiji.[14]
Smatra se i da je kalneksin prognostički marker i potencijalni terapijski cilj kod raka debelog crijeva.[15]
Izvori
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 • Nepoznat parametar:
issue
• Parametardatenije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ 2,0 2,1 • Nepoznat parametar:
first6
• Nepoznat parametar:issue
• Nepoznat parametar:last7
• Nepoznat parametar:issn
• Nepoznat parametar:last6
• Nepoznat parametar:first7
• Parametardatenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal - ↑ 3,0 3,1 3,2 • Nepoznat parametar:
issn
• Nepoznat parametar:pmc
• Nepoznat parametar:issue
• Parametardatenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametarpmidnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal - ↑ 4,0 4,1
• Nepoznat parametar:
editor-last
• Nepoznat parametar:editor-first - ↑ • Parametar
typenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ • Parametar
typenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ 7,0 7,1 • Nepoznat parametar:
issn
• Parametardatenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametarpmidnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal - ↑ • Nepoznat parametar:
first8
• Nepoznat parametar:first6
• Nepoznat parametar:issue
• Nepoznat parametar:last7
• Nepoznat parametar:last8
• Nepoznat parametar:last9
• Nepoznat parametar:first9
• Nepoznat parametar:last6
• Nepoznat parametar:first7
• Nepoznat parametar:issn
• Parametardatenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal - ↑ • Parametar
typenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ • Nepoznat parametar:
first6
• Nepoznat parametar:issue
• Nepoznat parametar:last7
• Nepoznat parametar:issn
• Nepoznat parametar:last6
• Nepoznat parametar:first7
• Parametardatenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal - ↑ 11,0 11,1 11,2 • Nepoznat parametar:
issue
• Nepoznat parametar:issn
• Parametardatenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametarpmidnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal - ↑ • Parametar
typenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ • Nepoznat parametar:
issue
• Nepoznat parametar:issn
• Parametardatenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal
• Parametarpmidnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal - ↑ • Parametar
typenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal - ↑ • Nepoznat parametar:
first8
• Nepoznat parametar:first10
• Nepoznat parametar:issue
• Nepoznat parametar:last9
• Nepoznat parametar:last10
• Nepoznat parametar:issn
• Nepoznat parametar:first6
• Nepoznat parametar:first7
• Nepoznat parametar:last6
• Nepoznat parametar:last7
• Nepoznat parametar:last11
• Nepoznat parametar:first11
• Nepoznat parametar:last8
• Nepoznat parametar:pmc
• Nepoznat parametar:first9
• Parametardatenije dopušten u klasijournal
• Parametarpmidnije dopušten u klasijournal
• Parametartypenije dopušten u klasijournal
• Parametarurlnije dopušten u klasijournal