Kalijev karbonat: razlika između inačica
Bot: Automatski unos stranica |
m Zamjena teksta - '<!--'''K(.*)'''-->' u '' |
||
| Redak 1: | Redak 1: | ||
[[Datoteka:Potassium carbonate.svg|mini|200px|Struktura kalijevog karbonata]] | |||
[[Datoteka:Potassium carbonate.jpg|mini|200px|Kalijev karbonat]] | [[Datoteka:Potassium carbonate.jpg|mini|200px|Kalijev karbonat]] | ||
'''Kalijev karbonat''' (također i '''potaša''', od [[njemački|njem.]] ''Pottasche'' : ''Pott'' -lonac + ''Asche'' -pepeo, rjeđe ''pepeljika''), '''[[kalij|K]]<sub>2</sub>[[ugljik|C]][[kisik|O]]<sub>3</sub>''' je kalijeva sol [[Ugljična kiselina|ugljične kiseline]]. | '''Kalijev karbonat''' (također i '''potaša''', od [[njemački|njem.]] ''Pottasche'' : ''Pott'' -lonac + ''Asche'' -pepeo, rjeđe ''pepeljika''), '''[[kalij|K]]<sub>2</sub>[[ugljik|C]][[kisik|O]]<sub>3</sub>''' je kalijeva sol [[Ugljična kiselina|ugljične kiseline]]. | ||
Posljednja izmjena od 27. svibanj 2025. u 13:43
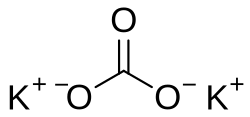
Kalijev karbonat (također i potaša, od njem. Pottasche : Pott -lonac + Asche -pepeo, rjeđe pepeljika), K2CO3 je kalijeva sol ugljične kiseline.
Osobine i svojstva
Dolazi u kao prozirna kristalična krutina ili bijeli higroskopni prah tališta 891 °C, lako i dobro topljiv u vodi (112.g u 100ml vode), koji daje vrlo lužnatu otopinu. Relativna gustoća na 20 °C mu je 2.29 g/cm3.
Svrstava se među prve dobivene čiste kemikalije iz prirode. Od 1500-ih godina, do početka 20. stoljeća bila je jedna od najvažnijih industrijskih kemikalija.
Dobivanje
Nekad se pripravljala/o ispiranjem drvnoga pepela vodom i isparavanjem otopine do suhoga.
Danas se dobiva uvođenjem ugljikova dioksida u kalijevu lužinu (otopinu kalijeva hidroksida) ili pak elektrolizom nekih kalijevih soli
Upotreba
Rabi se u velikim količinama u proizvodnji stakla, pripravi drugih kalijevih soli, sapuna, za apsorpciju CO2, u industriji keramike i fotografije, te za produkciju sredstava za pranje.
Izvori
- Hrvatska enciklopedija (LZMK), Broj 5 (Hu-Km), str. 446. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 2003.g. ISBN 953-6036-35-5