Kemijska formula: razlika između inačica
Bot: Automatski unos stranica |
m file->datoteka |
||
| Redak 18: | Redak 18: | ||
|klorovodik||HCl||HCl||HCl||align="center"|HCl|| | |klorovodik||HCl||HCl||HCl||align="center"|HCl|| | ||
|- | |- | ||
|octena kiselina||CH<sub>2</sub>O||C<sub>2</sub>H<sub>4</sub>O<sub>2</sub>||CH<sub>3</sub>-CO-OH||align="center"|[[ | |octena kiselina||CH<sub>2</sub>O||C<sub>2</sub>H<sub>4</sub>O<sub>2</sub>||CH<sub>3</sub>-CO-OH||align="center"|[[Datoteka:Acetic acid 2.svg|100px]]|| | ||
|- | |- | ||
|etin||CH||C<sub>2</sub>H<sub>2</sub>||HCΞCH||align="center"|H-CΞC-H|| | |etin||CH||C<sub>2</sub>H<sub>2</sub>||HCΞCH||align="center"|H-CΞC-H|| | ||
|- | |- | ||
|benzen||CH||C<sub>6</sub>H<sub>6</sub>||[[Datoteka:Benzene circle.png]]||align="center"|[[ | |benzen||CH||C<sub>6</sub>H<sub>6</sub>||[[Datoteka:Benzene circle.png]]||align="center"|[[Datoteka:Benz1.png|100px]]|| | ||
|- | |- | ||
|etanol||C<sub>2</sub>H<sub>6</sub>O||C<sub>2</sub>H<sub>6</sub>O||CH<sub>3</sub>-CH<sub>2</sub>-OH||align="center"|[[ | |etanol||C<sub>2</sub>H<sub>6</sub>O||C<sub>2</sub>H<sub>6</sub>O||CH<sub>3</sub>-CH<sub>2</sub>-OH||align="center"|[[Datoteka:Ethanol-2D-flat.png|100px]]|| | ||
|- | |- | ||
|metoksimetan||C<sub>2</sub>H<sub>6</sub>O||C<sub>2</sub>H<sub>6</sub>O||CH<sub>3</sub>-O-CH<sub>3</sub>||align="center"|[[ | |metoksimetan||C<sub>2</sub>H<sub>6</sub>O||C<sub>2</sub>H<sub>6</sub>O||CH<sub>3</sub>-O-CH<sub>3</sub>||align="center"|[[Datoteka:Dimethylether.PNG|100px]]|| | ||
|- | |- | ||
|mliječna kiselina||CH<sub>2</sub>O||C<sub>3</sub>H<sub>6</sub>O<sub>3</sub>||CH<sub>3</sub>-CH(OH)-COOH||[[ | |mliječna kiselina||CH<sub>2</sub>O||C<sub>3</sub>H<sub>6</sub>O<sub>3</sub>||CH<sub>3</sub>-CH(OH)-COOH||[[Datoteka:Milchsäure Enantiomerenpaar.svg]]|| | ||
|- | |- | ||
|glukoza||CH<sub>2</sub>O||C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>||HOCH<sub>2</sub>-[CH(OH)]<sub>4</sub>-CHO||[[ | |glukoza||CH<sub>2</sub>O||C<sub>6</sub>H<sub>12</sub>O<sub>6</sub>||HOCH<sub>2</sub>-[CH(OH)]<sub>4</sub>-CHO||[[Datoteka:D-glucose chain (Fischer).svg]]Fischerova||[[Datoteka:Beta-D-Glucopyranose.svg]]Haworthova | ||
|} | |} | ||
| Redak 47: | Redak 47: | ||
Sažeto ćemo formule [[Kompleksni spojevi|kompleksnih spojeva]] pisati kao u prethodnim primjerima, međutim najzornije je formulu prikazati „trodimenzionalno”. | Sažeto ćemo formule [[Kompleksni spojevi|kompleksnih spojeva]] pisati kao u prethodnim primjerima, međutim najzornije je formulu prikazati „trodimenzionalno”. | ||
<gallery> | <gallery> | ||
Datoteka:Tetraminkupfersulfathydrat.png|Bakrov tetraaminosulfat hidtat [Cu(NH<sub>3</sub>)<sub>4</sub>]SO<sub>4</sub>·H<sub>2</sub>O | |||
Datoteka:(RhA5Cl)Cl2.png|Rodijev pentaminotriklorid [Rh(NH<sub>3</sub>)<sub>5</sub>Cl]Cl<sub>2</sub> | |||
Datoteka:M(edds).png|Kompleks kationa metala i EDTA | |||
</gallery> | </gallery> | ||
Posljednja izmjena od 29. travanj 2022. u 20:41
- Kemijska formula je skraćeni oblik prikazivanja sastava i građe molekula, iona ili općenito formulskih jedinki tvari s pomoću simbola kemijskih elemenata.[1]
Tako npr. formula H2O označuje molekulu vode, koja se sastoji od dvaju atoma vodika (simbol H) i jednog atoma kisika (simbol O).
Vrste kemijskih formula
Kemijske se formule razlikuju prema informacijama koje pružaju.
- Formula elementarne tvari predočuje molekulu odnosno skup istovrsnih atoma koji se nalaze u molekuli elementarne tvari (H2, P4, S8)
- Empirijska formula pokazuje samo relativne omjere broja pojedinih atoma u jedinki, a određuje se na temelju masenih udjela pojedinih elemenata u spoju dobivenih elementarnom analizom.
- Molekulska formula pokazuje točan broj atoma u jedinki (molekuli), a određuje se iz empirijske formule i poznate mase molekule.
- Strukturna formula prikazuje način povezivanja atoma u molekuli, a određuje se nakon identifikacije funkcionalnih skupina molekule (alkoholna, aldehidna, kiselinska, aminska i dr.), najčešće spektroskopskim tehnikama.
- Sažeta strukturna formula je strukturna formula napisana jednostavnije, često u jednom retku, prikazane su atomske skupine i atomi ali način njihova povezivanja nije posve jasan.
- Stereokemijska formula prikazuje prostornu orijentaciju atoma u molekuli različitim vrstama projekcija koje uključuju mnoge dodatne konvencije. Prostorni raspored atoma izravno se određuje difrakcijskim metodama strukturne analize.
| naziv spoja | empirijska formula | molekulska formula | sažeta strukturna formula | strukturna formula | projekcijska formula |
|---|---|---|---|---|---|
| klorovodik | HCl | HCl | HCl | HCl | |
| octena kiselina | CH2O | C2H4O2 | CH3-CO-OH | 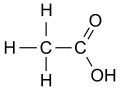 |
|
| etin | CH | C2H2 | HCΞCH | H-CΞC-H | |
| benzen | CH | C6H6 | 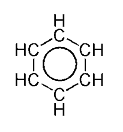 |
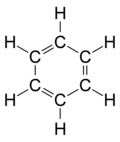 |
|
| etanol | C2H6O | C2H6O | CH3-CH2-OH | Datoteka:Ethanol-2D-flat.png | |
| metoksimetan | C2H6O | C2H6O | CH3-O-CH3 | Pogreška pri izradbi sličice: | |
| mliječna kiselina | CH2O | C3H6O3 | CH3-CH(OH)-COOH | Datoteka:Milchsäure Enantiomerenpaar.svg | |
| glukoza | CH2O | C6H12O6 | HOCH2-[CH(OH)]4-CHO | Datoteka:D-glucose chain (Fischer).svgFischerova | Datoteka:Beta-D-Glucopyranose.svgHaworthova |
Formulska jedinka
Formulsku jedinka je najmanji omjer broja aniona i kationa u ionskom spoju koji prikazujemo formulom spoja. Ionska tvar je ogroman skup aniona i kationa koji su povezani ionskom vezom (elektrostatskom). U ionskoj tvari naizmjenično su raspoređeni anioni i kationi, odnosno svaki anion je okružen određenim brojem kationa i obrnuto. Ne postoji molekula ionskog spoja već je cijeli spoj jedna „velika molekula”. Zato formula ionskog spoja pokazuje samo najmanji omjer broja aniona i kationa u spoju, odnosno prikazuje formulsku jedinku.[2]
Formula CaCl2 govori da se u kalcijevom kloridu kationi (Ca2+) i anioni (Cl-) nalaze u omjeru 1:2 te je CaCl2 formulska jedinka kalcijeva klorida.
U najširem smislu svaka formula predstavlja formulsku jedinku.
Formule hidratnih soli
Kristali hidratnih soli imaju u svom sastavu vezanu kristalnu vodu. Formula spoja se piše primjerice ovako: CuSO4∙5H2O. Točka u formuli ne predstavlja znak množenja već ju treba razumjeti kao znak zbrajanja (plus). Voda je uklopljena u kristalnu strukturu spoja. Napisana formula je sažeti oblik pisanja. Zapravo formulu bi pravilnije trebalo pisati ovako: [Cu(H2O)4]SO4∙H2O. Četiri molekule vode se koordiniraju s ionom bakra, dok je peta molekula vode povezana sa sulfatnim ionom. Isto tako MgSO4∙7H2O je zapravo [Mg(H2O)6]SO4∙H2O. Uglate zagrade u pisanju se koriste za pisanje formula kompleksnih spojeva.
Formule kompleksnih spojeva
Sažeto ćemo formule kompleksnih spojeva pisati kao u prethodnim primjerima, međutim najzornije je formulu prikazati „trodimenzionalno”.
-
Bakrov tetraaminosulfat hidtat [Cu(NH3)4]SO4·H2O
-
Rodijev pentaminotriklorid [Rh(NH3)5Cl]Cl2
-
Kompleks kationa metala i EDTA
Izvori
- ↑ [1] Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija: Kemijska formula
- ↑ Habuš, Tomašić, Liber: Opća kemija 1, 1. izd., Profil, Zagreb, 2014., ISBN 978-953-12-1434-6, str. 102.